Modelli animali per la ricerca traslazionale sul dolore
Introduzione
Nella ricerca preclinica si utilizzano gli animali per studiare l'eziologia e la fisiopatologia del dolore, svelare le vie di trasduzione del segnale, identificare e valutare nuove molecole e regioni bersaglio, sviluppare strategie terapeutiche e analizzarne l'efficacia. Il vantaggio offerto dalla sperimentazione animale è dato dal fatto che elementi rilevanti per il dolore acuto e i fattori coinvolti nello sviluppo e nel mantenimento del dolore cronico possono essere studiati sistematicamente per trovare relazioni causali, cosa che spesso non è possibile negli esseri umani.
Esempi di sperimentazione animale includono lo studio dei meccanismi genetici, molecolari e cellulari delle condizioni patologiche del dolore [5]. I ricercatori stanno inoltre sviluppando e utilizzando modelli animali preclinici per valutare le complessità sensoriali e psicologiche del dolore cronico [1; 7] (Figura 1).
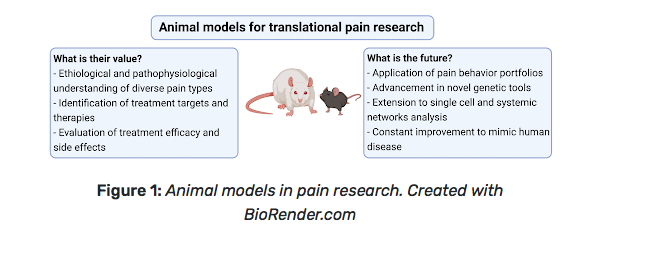
Sono stati sviluppati modelli animali di lesioni e malattie per studiare i processi del dolore e i possibili trattamenti
Il dolore è un'esperienza multidimensionale che può differire ampiamente da paziente a paziente in base alla malattia o al tipo di lesione e alla parte del corpo colpita.
Sono stati sviluppati diversi modelli animali che imitano molte condizioni di dolore acuto e cronico. Vengono utilizzate diverse specie di animali, di sesso ed età diversi e nella progettazione degli studi vengono presi in considerazione molti altri importanti fattori traslazionali.
I roditori sono usati principalmente perché mostrano un alto grado di somiglianza con i geni e il sistema nervoso degli esseri umani (Zheng-Bradley et al., 11]. È disponibile un’ampia gamma di modelli che sono costantemente ampliati e modificati in risposta alle necessità cliniche [1; 4; 7]. I modelli hanno consentito di studiare i meccanismi alla base del dolore neuropatico, il ruolo dell'infiammazione in condizioni dolorose, come l'artrite, e persino di indagare su sindromi complesse, come la fibromialgia e la lombalgia.
Valutazioni di tipo comportamentale sono utilizzate per valutare i risultati sperimentali e vengono classificate in risposta automatica involontaria, risposta non involontaria, test a scelta libera o comportamenti volontari non evocati e si riferiscono alla valutazione delle varie esperienze sensoriali ed emotive del dolore [8; 9]. Le valutazioni della risposta automatica involontaria misurano la sensibilità a stimoli meccanici o termici al caldo o al freddo. Le valutazioni della risposta non involontaria valutano la funzione fisica, come l'attività locomotoria che può essere correlata al dolore. Le valutazioni a scelta libera vengono utilizzate per correlare il dolore con i processi di ricompensa. L'indagine sul comportamento nella gabbia o l'esecuzione di attività motivazionali volontarie come correre nella ruota può fornire informazioni sul benessere degli animali.
Importanza della somiglianza di un modello animale ad aspetti della condizione umana
Esistono varie differenze tra i modelli animali e l'esperienza clinica dei pazienti, il che limita la capacità di tradurre i risultati degli esperimenti sugli animali. In primo luogo, il dolore è spesso studiato in animali maschi giovani, sani e geneticamente simili. Ciò contrasta con la situazione clinica in cui il dolore si manifesta prevalentemente in pazienti di sesso femminile, di mezza età o anziane, con comorbidità, polifarmacia e con background genetico eterogeneo. In secondo luogo, gli animali non simulano efficacemente la natura multidimensionale delle condizioni cliniche del dolore, che sono influenzate da complesse componenti psicologiche, parametri sociali, livello di istruzione e fattori ambientali. In terzo luogo, i modelli animali non hanno la natura degenerativa delle malattie croniche umane che progrediscono negli anni anziché in settimane, come accade nella maggior parte degli esperimenti di laboratorio. Infine, il dolore non può essere misurato direttamente nei modelli animali; i ricercatori devono fare affidamento su comportamenti surrogati, mentre il dolore del paziente viene misurato attraverso l'auto-segnalazione [10].
La sperimentazione animale deve essere condotta secondo linee guida etiche
Durante il processo decisionale di approvazione di una sperimentazione, se giustificata o meno, un comitato di valutazione istituzionale indipendente verifica se il presumibile dolore e angoscia sperimentati dagli animali saranno ridotti al minimo e li valuta rispetto ai potenziali benefici scientifici. Viene utilizzato il sistema delle delle 3R (reduction, refinement and replacement) per valutare e includere la riduzione al minimo di danni agli animali utilizzati nella ricerca [6]. La sostituzione (replacement) si riferisce a tecnologie che sostituiscono o evitano l'uso di animali negli esperimenti. La riduzione (reduction) si riferisce a metodi che riducono al minimo il numero di animali utilizzati in un esperimento senza pregiudicare gli obiettivi scientifici. L’affinamento/miglioramento (refinement) si riferisce a metodi che riducono al minimo la sofferenza. Si applica a tutti gli aspetti dell'uso degli animali, dal loro alloggiamento alle procedure scientifiche.
La ricerca sugli animali ha reso possibile il passaggio dalla ricerca allo sviluppo, anche recente, di farmaci per alcune condizioni di dolore
Diversi nuovi farmaci sono stati introdotti negli ultimi anni sulla base di evidenze che provenivano dalla ricerca sugli animali. Ad esempio, il peptide correlato al gene della calcitonina (CGRP) è stato scoperto nel 1982 [2]. In successivi studi sugli animali, è stato descritto il suo ruolo nel riflesso trigemino-vascolare alla base dell'emicrania. Parallelamente, studi sull'uomo hanno dimostrato il rilascio di CGRP nel plesso venoso giugulare durante un attacco di emicrania. Dal 2018, gli anticorpi e gli antagonisti CGRP sono stati approvati per la prevenzione dell'emicrania. Un ulteriore esempio sono gli inibitori della ciclossigenasi-2 (COX-2) specifici dell'isoenzima per il trattamento del dolore associato ad alti livelli di infiammazione[3]. Negli anni ’90 i modelli animali hanno aiutato a identificare la Cox-2 nel tessuto cerebrale e la sua sovraregolazione in risposta all'infiammazione. Di conseguenza, il celecoxib (un inibitore della COX-2) è ampiamente approvato come trattamento del dolore infiammatorio.
Ci sono stati alcuni farmaci che hanno mostrato risultati promettenti negli studi sugli animali, ma hanno fallito nella pratica clinica a causa delle differenze di specie. Se ne parla nella scheda informativa “Cellule umane e tessuti negli studi preclinici: il DRG”.
I ricercatori lavorano incessantemente per migliorare l'accuratezza e l'affidabilità dei modelli animali
La sfida per chi si occupa di ricerca preclinica sul dolore consiste nel modellare negli animali, In modo sufficiente, gli aspetti della complessità dell'esperienza del dolore del paziente per indagare e migliorare la nostra comprensione dei meccanismi sottostanti. Diversi progressi tecnologici vengono impiegati per migliorare la nostra comprensione dei processi del dolore, ad esempio, indagini unicellulari e imaging ad alta risoluzione in vivo. Gli scienziati continuano a sviluppare e a perfezionare modelli animali per simulare più da vicino la malattia sottostante e la manifestazione clinica del dolore. I possibili trattamenti vengono valutati utilizzando una gamma più ampia di valutazioni comportamentali per includere i cambiamenti sensoriali e psicosociali dovuti al dolore. Inoltre, la revisione sistematica e la meta-analisi degli studi sugli animali aiutano a ottenere una visione completa della validità e dell'utilità degli studi. L'obiettivo futuro è quello di colmare il gap traslativo, in modo che le potenziali terapie efficaci negli esperimenti sugli animali siano efficaci anche per i pazienti.
Autori
Anke Tappe-Theodor: Pharmacology Institute, Medical Faculty Heidelberg, Heidelberg University, Germany
Emily S. Sena: Centre for Clinical Brain Sciences, University of Edinburgh, United KingdomHeike L. Rittner, MD: Center for Interdisciplinary Pain Medicine, Dept Anesthesiology, University Hospitalof Wuerzburg, Germany
Nadia Soliman: Pain Group, Department of Surgery and Cancer, Imperial College London, United Kingdom
Traduzione a cura di
Lorenza Saini, Associazione Italiana per lo Studio del Dolore
Daniele Battelli, EDPM, MD Specialist in Anestesia, Terapia intensiva e Terapia del Dolore, Ospedale di Stato della Repubblica di San Marino
Bibliografia
[1] Burma NE, Leduc-Pessah H, Fan CY, Trang T. Animal models of chronic pain: Advances and challenges for clinical translation. Journal of Neuroscience Research 2017;95(6):1242-1256.
[2] Edvinsson L, Haanes KA, Warfvinge K, Krause DN. CGRP as the target of new migraine therapies – successful translation from bench to clinic. Nat Rev Neurol 2018;14(6):338-350.
[3] Flower RJ. The development of COX2 inhibitors. Nat Rev Drug Discov 2003;2(3):179-191.
[4] Henze DA, Urban MO. Large Animal Models for Pain Therapeutic Development. In: L Kruger, AR Light, editors. Translational Pain Research: From Mouse to Man. Boca Raton (FL): CRC Press/Taylor & Francis
Copyright © 2010 by Taylor and Francis Group, LLC., 2010.
[5] Lacroix-Fralish ML, Mogil JS. Progress in genetic studies of pain and analgesia. Annual review of pharmacology and toxicology 2009;49:97-121.
[6] NC3Rs, BBSRC, Defra, MRC, NERC, Society R, Trust W. Responsibility in the use of animals in bioscience research: expectations of the major research councils and charitable funding bodies. 2019.
[7] Sadler KE, Mogil JS, Stucky CL. Innovations and advances in modelling and measuring pain in animals. Nature reviews Neuroscience 2021.
[8] Tappe-Theodor A, King T, Morgan MM. Pros and Cons of Clinically Relevant Methods to Assess Pain in Rodents. Neurosci Biobehav Rev 2019;100:335-343.
[9] Tappe-Theodor A, Kuner R. Studying ongoing and spontaneous pain in rodents–challenges and opportunities. Eur J Neurosci 2014;39(11):1881-1890.
[10] Vierck CJ, Hansson PT, Yezierski RP. Clinical and pre-clinical pain assessment: are we measuring the same thing? Pain 2008;135(1-2):7-10.
[11] Zheng-Bradley X, Rung J, Parkinson H, Brazma A. Large scale comparison of global gene expression patterns in human and mouse. Genome Biology 2010;11(12):R124.
Per il comunicato di presentazione e l'indice delle altre schede informative clicca qui